2024年10月7日,美國紐約西奈山伊坎醫學院和愛因斯坦醫學院、英國愛丁堡大學、澳大利亞西澳大學、西班牙國家癌癥中心的Julio A. Aguirre-Ghiso團隊的研究人員,在國際知名期刊Cell(IF:45.5)發表了題為“Lung-resident alveolar macrophages regulate the timing of breast cancer metastasis”的研究性論文。發現肺泡巨噬細胞(AM)會誘導擴散性癌細胞(DCC)休眠,并且這是由DCC和AM之間的TGF-β2-TGF-βRIII信號傳導介導的,隨著癌細胞的進化,DCC下調TGF-βRIII表達,與AM的互作降低,使得其可以逃避免疫控制。

擴散性癌細胞(DCC)可以在癌癥早期擴散,并保持休眠狀態長期存在于其他器官中,直到出現癌癥轉移癥狀,如乳腺擴散性癌細胞可以在肺部中維持長期休眠狀態,但是其中的機制仍不清楚。
研究人員首先利用單細胞RNA-seq檢測了早期和晚期DCC如何影響肺部巨噬細胞的轉錄組,發現穩態的肺泡巨噬細胞(AM)是早期DCC肺部定植時的主要巨噬細胞類群,這些AM表達細胞周期基因,說明具有自我更新潛能,晚期DCC會導致AM的炎癥基因上調。接下來他們檢測了AM的定位,免疫熒光結果顯示,DCC定位于肺泡腔中,并且與AM相鄰甚至直接接觸。在小鼠肺部中,AM與DCC物理互作,并誘導間質樣(M-like)表型。然后他們利用體外3D共培養模型來檢測AM和早期DCC前體細胞互作如何影響癌細胞行為,發現AM和早期DCC共培養會增加擴散性間質細胞樣克隆數目,并導致生長抑制,表現為克隆形成減少。因此,早期DCC可以在與AM互作后激活間質樣和生長停滯程序。他們還檢測了晚期進化的癌細胞,發現它們在與AM接觸后雖然仍表現出間質樣表型,但并不出現生長抑制。上述結果表明AM可能創造了一種促進DCC休眠的微環境,作為一種低于癌癥轉移的屏障,并可能隨著癌癥的進展而逐漸消失,而且早期的DCC可能可以促進AM維持這種狀態。于是研究人員使用荷蘭LIPOSOMA的巨噬細胞清除劑Clodronate Liposomes氯膦酸二鈉脂質體(貨號:CP-005-005)耗竭/清除了所有的AM細胞,2周后檢測發現并不會影響肺部DCC的數目,但是增殖的DCC數目顯著增加。因此,敲除AM細胞可以喚醒沉睡的DCC,促進癌癥轉移。
然后他們通過RNA-seq來分析不同細胞類型之間的配體-受體互作,發現Osm-Osmr/Lifr和Tgfb-Tgfbr可以調控AM功能和癌細胞休眠。然后他們對DCC前體細胞進行了基因編輯,使其編碼三種不同的靶向TGF-βRIII和OSMR的四環素誘導的shRNA序列,通過尾靜脈注射到小鼠體內,發現敲降TGF-βRIII可以顯著促進癌癥肺轉移,而敲降OSMR不能喚醒沉睡的DCC。因此,AM是通過TGF-β來誘導DCC休眠的。接著他們發現晚期DCC與AM的互作顯著降低,并且TGF-βRIII的表達量也顯著降低,過表達TGF-βRIII可以恢復AM對晚期DCC的生長抑制,因此,晚期DCC通過下調TGF-βRIII和降低與AM的互作來逃避AM誘導的休眠。
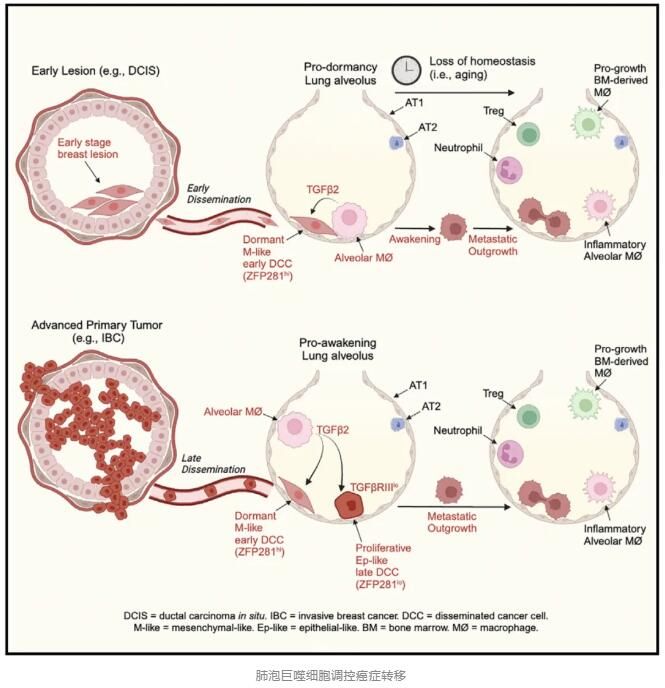
因此,該研究結果表明,肺泡巨噬細胞可以充當乳腺癌轉移免疫屏障,誘導并且維持播散至肺部的乳腺癌細胞處于休眠狀態,轉化生長因子β2信號傳導下調,可使癌細胞能夠克服巨噬細胞產生癌癥生長抑制作用。該研究結果為催眠乳腺癌細胞、避免乳腺癌轉移奠定了基礎。
原始文獻
Dalla, Erica et al., Lung-resident alveolar macrophages regulate the timing of breast cancer metastasis, Cell (2024). https://www.cell.com/cell/abstract/S0092-8674(24)01034-1

獨家代理
中國大陸地區
生產廠家
歐洲荷蘭王國
獨家代理
香港臺灣澳門
Copyright ? 2004-2023 靶點科技(北京)有限公司. 版權所有. 京ICP備18027329號-1