歡迎光臨 www.fanjinbao.com
歡迎光臨 www.fanjinbao.com
2024年9月13日,波士頓兒童醫(yī)院/哈佛大學(xué)的Leonard I. Zon教授團(tuán)隊(duì),在國(guó)際知名期刊Science(IF=56.9)在線發(fā)表題為:Transcripts of repetitive DNA elements signal to block phagocytosis of hematopoietic stem cells的論文。 作者使用斑馬魚模型和哺乳動(dòng)物系統(tǒng)來(lái)研究HSPCs內(nèi)可能阻止巨噬細(xì)胞吞噬它們的信號(hào),揭示了調(diào)控巨噬細(xì)胞與HSPCs相互作用的一種新機(jī)制,并為如何影響HSPCs的命運(yùn)提供了新的理解。
巨噬細(xì)胞(Macrophages)是我們免疫系統(tǒng)的一部分,它們?cè)诿庖邞?yīng)答、炎癥反應(yīng)、組織修復(fù)以及許多其他生理過(guò)程中都起著重要的作用。巨噬細(xì)胞通過(guò)吞噬細(xì)菌、死亡細(xì)胞、病毒和其他外來(lái)物質(zhì)來(lái)清除它們。造血干細(xì)胞(Hematopoietic Stem Cells,HSCs)可以分化為所有類型的血細(xì)胞,包括紅血細(xì)胞、白血細(xì)胞和血小板。在某些情況下,巨噬細(xì)胞可以吞噬HSCs。例如,在骨髓移植后,巨噬細(xì)胞可能會(huì)吞噬移植的HSCs,這可能會(huì)導(dǎo)致移植失敗。此外,一些研究也發(fā)現(xiàn),在炎癥或感染的環(huán)境中,巨噬細(xì)胞可能會(huì)吞噬HSCs,可能是作為一種防御機(jī)制,以防止感染擴(kuò)散。
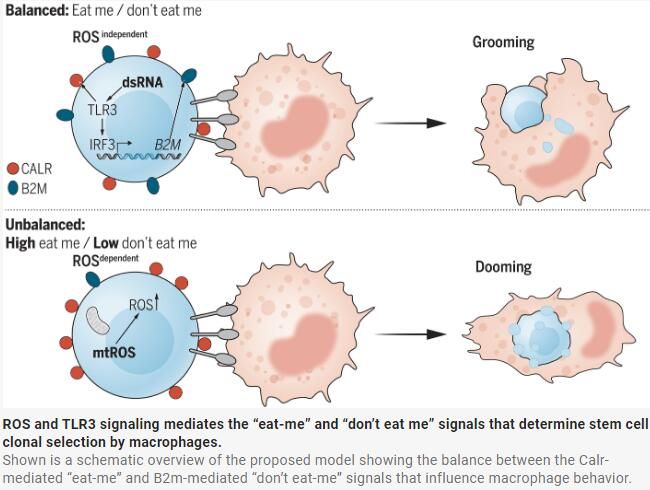
先天免疫細(xì)胞,如巨噬細(xì)胞和中性粒細(xì)胞,通過(guò)區(qū)分其表面表達(dá)的分子來(lái)協(xié)調(diào)清除或吞噬垂死細(xì)胞。表面分子,如補(bǔ)體、調(diào)理素、暴露的磷脂酰絲氨酸(PS)、鈣網(wǎng)蛋白(Calr)和膜聯(lián)蛋白I作為啟動(dòng)吞噬信號(hào)的信號(hào)。在特定情況下,這些表面分子在細(xì)胞表面高表達(dá)。相比之下,表面分子如β -2微球蛋白(B2m)充當(dāng)“不要吃我”信號(hào)。巨噬細(xì)胞對(duì)異常HSPC有吞噬和修飾兩種作用,但是機(jī)制不明。作者通過(guò)實(shí)時(shí)成像和體內(nèi)細(xì)胞條形碼技術(shù)證明了“吃我”和“不要吃我”信號(hào)之間的平衡分別由活性氧(ROS)和Toll樣受體3 (Tlr3)激活提供。
背景介紹:
造血干細(xì)胞 (HSC) 產(chǎn)生所有類型的血細(xì)胞,并確保造血系統(tǒng)的終生維持和補(bǔ)充。這些成體干細(xì)胞存在于骨髓 (BM) 中的特殊微環(huán)境中,但表現(xiàn)出一種獨(dú)特的行為,即其一小部分細(xì)胞群不斷從 BM 中排出,進(jìn)入血液循環(huán)——這一過(guò)程被稱為“干細(xì)胞動(dòng)員”。在臨床上,通過(guò)暴露于粒細(xì)胞集落刺激因子 (G-CSF) 或 C-X-C 趨化因子受體 4 型 (CXCR4) 拮抗劑,通過(guò)藥理學(xué)調(diào)節(jié)造血細(xì)胞因子信號(hào)傳導(dǎo)來(lái)強(qiáng)制 HSC 動(dòng)員,從而利用這一特性。從外周血中獲取動(dòng)員的造血干細(xì)胞用于隨后的造血干細(xì)胞移植,例如,用于治療癌癥、自身免疫性疾病和其他疾病患者。
在胚胎發(fā)育過(guò)程中,巨噬細(xì)胞與血液干細(xì)胞相互作用,去除那些表現(xiàn)出高水平細(xì)胞應(yīng)激的細(xì)胞。存活的造血干細(xì)胞和祖細(xì)胞 (HSPC) 可以在成人中增殖并產(chǎn)生血細(xì)胞系。Pessoa Rodrigues 等人使用斑馬魚模型和哺乳動(dòng)物系統(tǒng)來(lái)研究 HSPC 中可以防止巨噬細(xì)胞吞噬它們的信號(hào)。與先天免疫核酸感應(yīng)相關(guān)的分子促進(jìn)了 HSPCs 表面 β-2-微球蛋白的表達(dá),從而提高了它們與巨噬細(xì)胞相互作用時(shí)的存活率。損害該途徑減少了成年斑馬魚中不同干細(xì)胞克隆的數(shù)量。
造血干細(xì)胞和祖細(xì)胞 (HSPC) 在一生中都會(huì)產(chǎn)生成熟的血細(xì)胞。在此過(guò)程中,HSPC 與骨髓生態(tài)位中存在的各種細(xì)胞(包括巨噬細(xì)胞)相互作用。這些巨噬細(xì)胞通過(guò)釋放細(xì)胞因子和趨化因子并巡邏以去除應(yīng)激、死亡或衰老的細(xì)胞來(lái)介導(dǎo)無(wú)數(shù)過(guò)程。以這種方式,巨噬細(xì)胞有助于維持組織穩(wěn)態(tài)。在造血過(guò)程中,巨噬細(xì)胞確保正常造血干細(xì)胞的質(zhì)量,并決定參與成體造血的造血克隆的數(shù)量。然后,它們要么完全吞噬干細(xì)胞,稱為“厄運(yùn)”,要么捕獲干細(xì)胞細(xì)胞物質(zhì)的一部分,稱為“修飾”。梳理后,干細(xì)胞繼續(xù)分裂,而注定失敗的 HSPC 克隆被消除。
Calr的表達(dá)可由與ROS相關(guān)或不相關(guān)的過(guò)程誘導(dǎo)
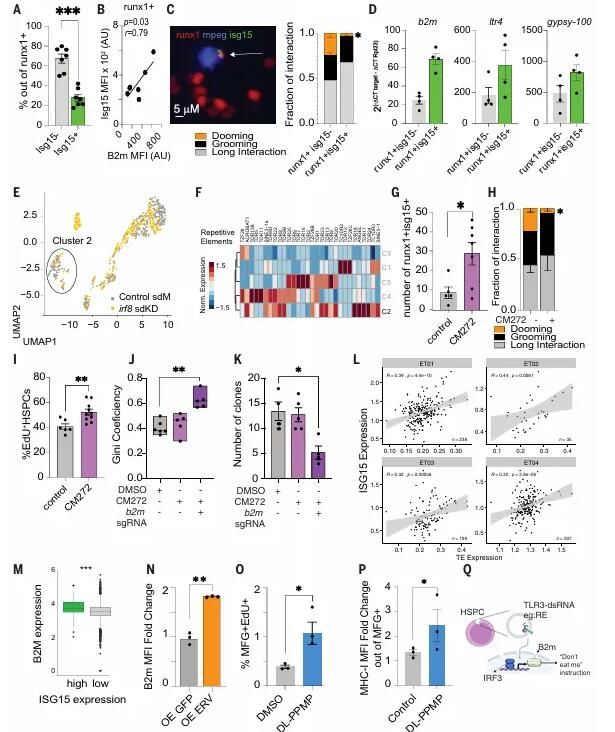
作者發(fā)現(xiàn)斑馬魚HSPC的ROS水平和表面的Calr呈正相關(guān),表明了ROS水平代表了更高的表面Calr表達(dá)。為了系統(tǒng)地評(píng)估HSPCs中觸發(fā)表面Calr呈遞的途徑,作者篩選了1200個(gè)生物活性小分子,發(fā)現(xiàn)93種化合物在細(xì)胞中以強(qiáng)大的劑量依賴性反應(yīng)增加表面Calr,54種與ROS增加相關(guān)(ROS依賴性),而39種不影響ROS水平(獨(dú)立于ROS)。93種Calr誘導(dǎo)劑中有22種以依賴于Calr3b的方式促進(jìn)了巨噬細(xì)胞-HSPC相互作用。Ros依賴性和Ros非依賴性化合物都以相似的水平增加巨噬細(xì)胞-HSPC相互作用比率。這些結(jié)果表明,細(xì)胞表面Calr水平?jīng)Q定了巨噬細(xì)胞-HSPC相互作用。
HSPC ROS水平?jīng)Q定巨噬細(xì)胞吞噬或者修飾
接下來(lái)作者探討了ROS依賴性和非依賴性化合物如何影響HSPCs與巨噬細(xì)胞的相互作用,以及這種相互作用如何決定HSPCs的命運(yùn),即被清除(dooming)或被保留(grooming)。研究發(fā)現(xiàn),抗氧化治療阻礙了暴露于ROS依賴性化合物的人類HSPCs表面熱休克蛋白CALR的水平。因此,推測(cè)促進(jìn)清除的化合物可能與由于線粒體功能障礙導(dǎo)致的更高ROS水平有關(guān)。相比之下,不依賴于ROS的化合物增加了HSPCs的增殖,這與增加的保留行為一致。這些結(jié)果暗示,HSPCs上的表面Calr呈現(xiàn)可以誘導(dǎo)巨噬細(xì)胞的交互,但該交互的結(jié)果也由HSPCs的細(xì)胞ROS水平?jīng)Q定。ROS依賴性化合物刺激了清除行為和HSPCs的死亡,而ROS非依賴性的化合物則刺激了保留行為和HSPCs的增殖。此外還測(cè)試了ROS非依賴化合物的體外處理的巨噬細(xì)胞的趨化性和吞噬活性。發(fā)現(xiàn)ROS獨(dú)立的Calr誘導(dǎo)劑并未改變固有的巨噬細(xì)胞功能。因此,ROS獨(dú)立化合物通過(guò)驅(qū)動(dòng)巨噬細(xì)胞介導(dǎo)的HSPCs保留行為,而不是誘導(dǎo)巨噬細(xì)胞自身效應(yīng),來(lái)實(shí)現(xiàn)其效果。
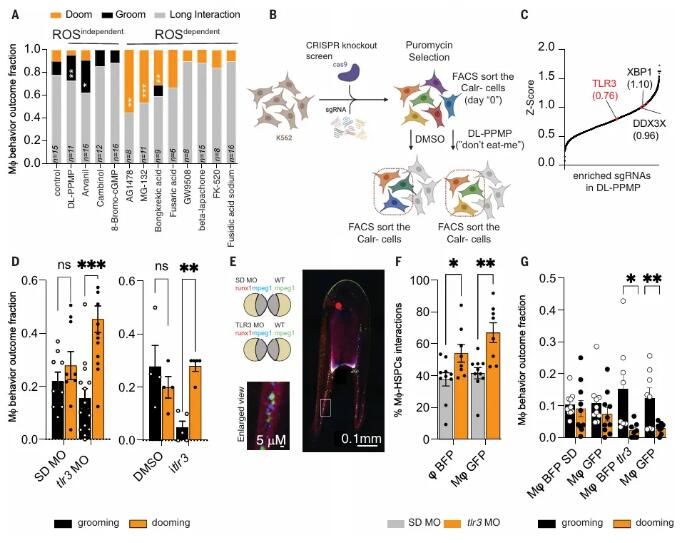
Tlr3是HSPC修飾所必需的
研究人員選擇了DL-PPMP作為ROS獨(dú)立的CALR誘導(dǎo)劑來(lái)探討ROS獨(dú)立化合物如何誘導(dǎo)HSPCs表面CALR的表達(dá)。為了定義需要表達(dá)表面CALR的復(fù)雜網(wǎng)絡(luò),研究者使用了一種遞送敲除文庫(kù)的逆轉(zhuǎn)錄病毒,該文庫(kù)針對(duì)18,080個(gè)基因。作者將DL-PPMP或DMSO(對(duì)照)處理的K562人類白血病細(xì)胞進(jìn)行分選,以獲得CALR-細(xì)胞并富集其中的單向?qū)NA (sgRNA)。作者發(fā)現(xiàn)DL-PPMP刺激細(xì)胞中富集的基因與胞質(zhì)DNA/RNA感應(yīng)和病毒免疫反應(yīng)有關(guān)。在驗(yàn)證實(shí)驗(yàn)中,TLR3的消耗降低了K562細(xì)胞中的表面Calr,表明胞質(zhì)DNA和/或RNA可能調(diào)節(jié)表面Calr的增加。
研究進(jìn)一步探索了DL-PPMP觸發(fā)的分子機(jī)制,并研究了Tlr3信號(hào)如何影響HSPCs的命運(yùn)。作者分析了先前可獲得的DL-PPMP處理過(guò)的人類癌細(xì)胞系的大量RNA測(cè)序數(shù)據(jù)。他們發(fā)現(xiàn)2285個(gè)上調(diào)基因與病毒免疫反應(yīng)相關(guān)的途徑有關(guān),例如干擾素-a(IFN-a)的產(chǎn)生、抗原處理以及通過(guò)MHC I類處理內(nèi)源性肽的呈現(xiàn)。在使用DL-PPMP處理的K562細(xì)胞中B2m(一種需要用于細(xì)胞表面的MHC-I穩(wěn)定的分子)的表達(dá)水平較高。作者評(píng)估了Tlr3斑馬魚形態(tài)素消耗后中HSPCs表面的B2m水平。他們發(fā)現(xiàn)在斑馬魚胚胎中消耗Tlr3導(dǎo)致B2m+ HSPCs的數(shù)量減少。研究結(jié)果表明,由于Tlr3表達(dá)水平較低導(dǎo)致的B2m表達(dá)降低,使得HSPCs更加傾向于被巨噬細(xì)胞清除。
表面B2m決定Calr介導(dǎo)巨噬細(xì)胞-HSPC相互作用的結(jié)果
接下來(lái)作者用ROS獨(dú)立的化合物處理48hpf的斑馬魚胚胎,并使用熒光激活細(xì)胞分選(FACS)評(píng)估了HSPCs上的表面B2m。他們發(fā)現(xiàn)ROS獨(dú)立的化合物增加了B2m水平,而"eat-me"或iTlr3處理則降低了表面B2m水平。作者生成了B2m穩(wěn)定敲除的斑馬魚以確認(rèn)B2m在巨噬細(xì)胞介導(dǎo)的HSPC保留中的角色,觀察到B2m消耗增加了HSPC的清除行為并減少了HSPC的保留行為,進(jìn)一步支持了表面B2m作為HSPCs上的"不要吞噬我"信號(hào)的角色。接下來(lái),他們用ROS獨(dú)立的化合物DL-PPMP處理了B2m敲除的胚胎。他們觀察到,DL-PPMP在WT和B2m敲除的胚胎中都刺激了相互作用。然而,B2m敲除的HSPCs被清除,而WT HSPCs則被保留。Tlr3激活級(jí)聯(lián)可能促進(jìn)Irf3激活,從而促進(jìn)b2m的轉(zhuǎn)錄。
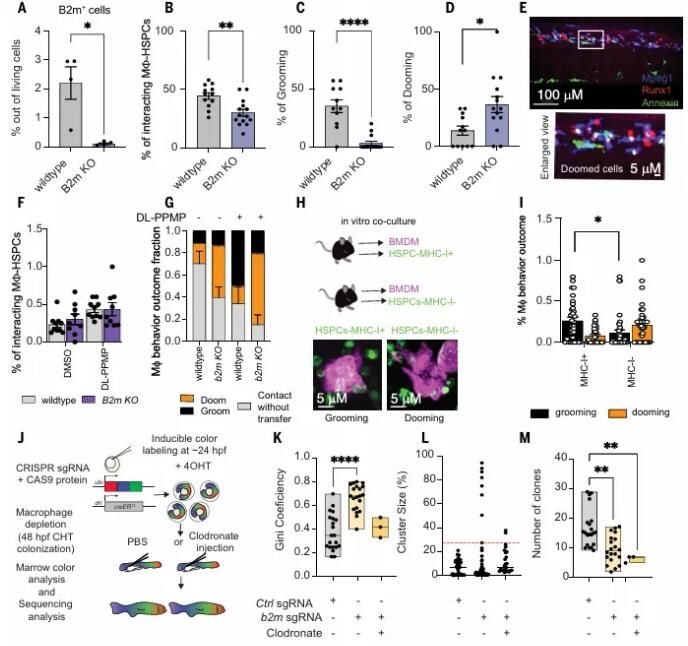
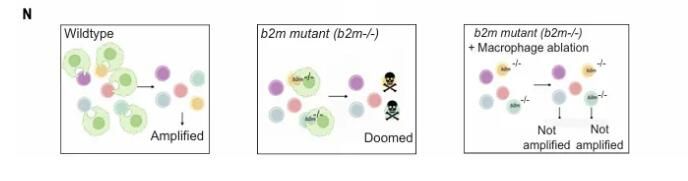
作者進(jìn)一步使用IFN-stimulated gene 15 (Isg15)作為Tlr3-介導(dǎo)的Irf3反應(yīng)的報(bào)告基因以研究HSPC種群的內(nèi)在異質(zhì)性。qPCR分析顯示,Runx1+Isg15+細(xì)胞中的內(nèi)源逆轉(zhuǎn)錄病毒和B2m表達(dá)均有所增加,這表明RE (repetitive elements)轉(zhuǎn)錄水平較高的HSPC也有更高的B2m水平。重新分析已發(fā)布的單細(xì)胞RNA-seq數(shù)據(jù),發(fā)現(xiàn)富含細(xì)胞周期基因表達(dá)的細(xì)胞群的RE表達(dá)較高,這表明準(zhǔn)備進(jìn)行增殖的HSPC有更高的RE表達(dá)。通過(guò)增加整體RE的表達(dá)或過(guò)表達(dá)特定的RE(Ltr4),都能保護(hù)HSPC免受巨噬細(xì)胞的清除。這些研究結(jié)果表明,通過(guò)增加內(nèi)源逆轉(zhuǎn)錄病毒的水平,可以提供對(duì)HSPC清除的保護(hù)。作者注意到,內(nèi)源逆轉(zhuǎn)錄病毒(ERV)的蛋白質(zhì)和遺傳物質(zhì)已經(jīng)被證明能夠調(diào)控內(nèi)源性免疫反應(yīng)。在病原體感染時(shí),ERV衍生的增強(qiáng)子和啟動(dòng)子似乎會(huì)被激活,這表明內(nèi)源性免疫反應(yīng)和ERV之間可能存在協(xié)同激活或訓(xùn)練免疫反應(yīng)的功能。所以進(jìn)一步評(píng)估了Tlr3信號(hào)在“應(yīng)急粒細(xì)胞生成”中的角色。他們發(fā)現(xiàn),poly I:C刺激后,中性粒細(xì)胞的數(shù)量增加,這表明可能誘發(fā)了應(yīng)急粒細(xì)胞生成。他們還發(fā)現(xiàn),急性髓系白血病(AML)的惡性HSPCs以及人類AML blast中,B2M和TE的表達(dá)較高。這表明AML細(xì)胞可能會(huì)“劫持”“不要吃我”信號(hào)來(lái)避免被巨噬細(xì)胞清除。總的來(lái)說(shuō),這些數(shù)據(jù)表明,RE-Tlr3的病毒模擬信號(hào)調(diào)控HSPCs上的B2m表達(dá),以促進(jìn)巨噬細(xì)胞介導(dǎo)的清除行為,并保護(hù)HSPCs免受巨噬細(xì)胞的消亡,塑造了HSC的命運(yùn)決定和克隆增殖。
總之,作者的研究結(jié)果支持一個(gè)模型,在該模型中,內(nèi)源性 TLR3 配體導(dǎo)致 b2m 的表達(dá),從而阻斷巨噬細(xì)胞誘導(dǎo)的厄運(yùn),并通過(guò)用巨噬細(xì)胞監(jiān)測(cè)干細(xì)胞質(zhì)量來(lái)確定造血干細(xì)胞克隆性。Calr (“吃我”)和 B2m(“不吃我”) 的平衡控制著通過(guò)巨噬細(xì)胞介導(dǎo)的質(zhì)量保證為成人血液系統(tǒng)做出貢獻(xiàn)的長(zhǎng)壽命 HSC 克隆的數(shù)量。這揭示了 HSPC 克隆擴(kuò)增和免疫調(diào)節(jié)細(xì)胞清除之間錯(cuò)綜復(fù)雜的相互作用。作者提出,這種保護(hù)機(jī)制也可能在成年期響應(yīng)環(huán)境壓力而發(fā)揮作用,例如在感染期間或克隆干細(xì)胞疾病中。通過(guò)利用巨噬細(xì)胞選擇性去除突變干細(xì)胞克隆,操縱“don't eat-me”和“eat-me”信號(hào)的水平可能對(duì)免疫療法具有重要的治療意義。
相關(guān)研究一:巨噬細(xì)胞對(duì)造血干細(xì)胞HSC的質(zhì)量控制
2022年9月22日,Science發(fā)表題為Quality assurance of hematopoietic stem cells by macrophages determines stem cell clonality研究論文,巨噬細(xì)胞是造血干細(xì)胞HSC質(zhì)量的控制者。詳情參考鏈接:巨噬細(xì)胞對(duì)造血干細(xì)胞HSC的質(zhì)量控制。 在2022年9月22日發(fā)表的論文中,作者使用了我們荷蘭Liposoma的巨噬細(xì)胞清除劑Clodronate Liposomes(貨號(hào)CP-005-005)氯膦酸二鈉脂質(zhì)體巨噬細(xì)胞清除套裝。在2024年8月9日的這篇研究中,作者使用了巨噬細(xì)胞示蹤熒光脂質(zhì)體Dil Liposomes。
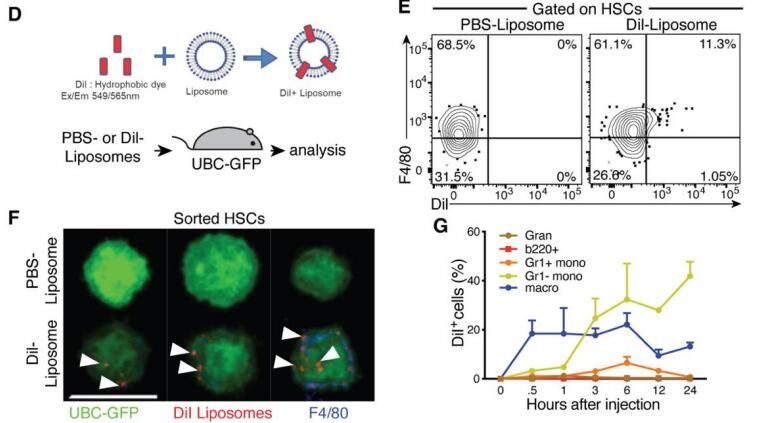
相關(guān)研究二:巨噬細(xì)胞通過(guò)胞啃作用介導(dǎo)膜物質(zhì)轉(zhuǎn)移到造血干細(xì)胞HSC
原始文獻(xiàn):
Cecilia Pessoa Rodrigues et al.Transcripts of repetitive DNA elements signal to block phagocytosis of hematopoietic stem cells.Science385,eadn1629(2024).DOI:10.1126/science.adn1629. https://www.science.org/doi/10.1126/science.adn1629

獨(dú)家代理
中國(guó)大陸地區(qū)
生產(chǎn)廠家
歐洲荷蘭王國(guó)
獨(dú)家代理
香港臺(tái)灣澳門
Copyright ? 2004-2023 靶點(diǎn)科技(北京)有限公司. 版權(quán)所有. 京ICP備18027329號(hào)-1