2024年11月22日,大阪大學(xué)Masahiro Yamamoto教授團(tuán)隊(duì),在國際知名期刊Science(IF=56.9)在線發(fā)表題為:Platelet factor 4–induced TH1-Treg polarization suppresses antitumor immunity的論文。研究了腫瘤相關(guān)巨噬細(xì)胞(TAMs)和血小板因子4(PF4)在腫瘤微環(huán)境(TME)中的作用,以及它們對T輔助1(TH1)極化的調(diào)節(jié)性T細(xì)胞(TH1-Treg細(xì)胞)和抗腫瘤免疫的影響。腫瘤微環(huán)境(TME)中存在多種免疫抑制細(xì)胞,其中調(diào)節(jié)性T細(xì)胞(Treg細(xì)胞)是一類重要的免疫細(xì)胞,在維持免疫穩(wěn)態(tài)和抑制自身免疫中發(fā)揮關(guān)鍵作用。然而,在TME中,Treg細(xì)胞會向TH1-Treg細(xì)胞極化,這種極化狀態(tài)會抑制抗腫瘤免疫。研究發(fā)現(xiàn),腫瘤相關(guān)巨噬細(xì)胞(TAMs)會分泌PF4,該因子可以促進(jìn)Treg細(xì)胞向TH1-Treg細(xì)胞極化。在腫瘤小鼠模型中,通過基因敲除或單克隆抗體中和PF4,可以減少TME中的TH1-Treg細(xì)胞數(shù)量,增強(qiáng)抗腫瘤免疫,并抑制腫瘤生長。此外,研究還發(fā)現(xiàn),PF4的中和抗體可以抑制TH1-Treg細(xì)胞的極化,從而抑制腫瘤生長。
介紹:
在腫瘤塊中,不僅存在腫瘤細(xì)胞,還存在各種非腫瘤細(xì)胞(如免疫細(xì)胞、成纖維細(xì)胞和血管細(xì)胞),形成所謂的腫瘤微環(huán)境 (TME)。TME 中的一些免疫細(xì)胞,如細(xì)胞毒性 CD8+ T 細(xì)胞和自然殺傷細(xì)胞,發(fā)揮抗腫瘤作用,而其他免疫細(xì)胞則表現(xiàn)出促腫瘤功能。調(diào)節(jié)性 T 細(xì)胞(Treg 細(xì)胞)是輔助性 CD4+ T 細(xì)胞的一個(gè)亞群,在維持健康個(gè)體的免疫穩(wěn)態(tài)和抑制自身免疫方面發(fā)揮著重要作用。在 Treg 細(xì)胞中,稱為輔助性 T 細(xì)胞 1 (TH1) 型 Treg (TH1-Treg 細(xì)胞)的亞群在腫瘤塊內(nèi)高度積累并抑制抗腫瘤免疫。靶向 TH1-Treg 細(xì)胞進(jìn)行去除可能是一種很有前途的癌癥免疫治療策略,因?yàn)樗徽J(rèn)為比去除所有 Treg 細(xì)胞更安全,后者可能導(dǎo)致自身免疫。然而,人們對驅(qū)動(dòng) TH1-Treg 細(xì)胞在 TME 中高度積累的分子機(jī)制知之甚少。
原理:
巨噬細(xì)胞是存在于各種組織中(包括 TME)的先天免疫細(xì)胞,它們可以分化為腫瘤相關(guān)巨噬細(xì)胞 (TAM),這是一種在促進(jìn)腫瘤生長和調(diào)節(jié)免疫反應(yīng)中起關(guān)鍵作用的特殊亞群。由于先前的研究表明,單克隆抗體 (mAb) 介導(dǎo)的巨噬細(xì)胞耗竭會減少 TME 中的 Treg 細(xì)胞,因此我們質(zhì)疑 TAMs 是否與 TME 中 TH1-Treg 細(xì)胞的存在增加有關(guān)。為了探索這種潛在的因果關(guān)系,我們開發(fā)了一種轉(zhuǎn)基因小鼠模型,其中 TAM 可以通過使用稱為 VeDTR 的交叉遺傳細(xì)胞靶向系統(tǒng)進(jìn)行特異性標(biāo)記和有條件地耗盡。我們假設(shè)使用這些小鼠將使我們能夠分析 TAM 耗竭對 TME 中 TH1-Treg 細(xì)胞群的影響,并揭示 TAMs 和 Treg 細(xì)胞之間的細(xì)胞通訊。
結(jié)果:
與其他組織駐留巨噬細(xì)胞相比,TAM 以高水平和排他性水平表達(dá)精氨酸酶 1 (Arg1)。當(dāng)我們在 VeDTR 系統(tǒng)中選擇 Cx3cr1 和 Arg1 基因時(shí), Arg1+巨噬細(xì)胞在荷瘤小鼠中被特異性靶向。使用這些小鼠,我們發(fā)現(xiàn) Arg1+巨噬細(xì)胞構(gòu)成了 TAM 的主要子集,并且在其他器官中未檢測到。在耗盡Arg1+TAM后,我們觀察到 TME 中腫瘤生長和 TH1-Treg 細(xì)胞比率降低。然后,我們檢查了Arg1+TAM是否誘導(dǎo) Treg 細(xì)胞極化為 TH1-Treg 細(xì)胞。與 Arg1+TAM共培養(yǎng)誘導(dǎo) TH1-Treg 細(xì)胞極化,即使沒有直接的物理相互作用。當(dāng)我們使用單細(xì)胞和批量 RNA 測序分析源自誘導(dǎo) TH1-Treg 細(xì)胞極化的Arg1+TAM的體液因子時(shí),我們確定了一種稱為血小板因子 4 (PF4) 的趨化因子作為 TH1-Treg 細(xì)胞極化的誘導(dǎo)劑,以 CXCR3 依賴性方式。在 Arg1+TAMs 中特異性檢測到巨噬細(xì)胞中 PF4 的高表達(dá),但在其他組織巨噬細(xì)胞中未檢測到。此外,我們發(fā)現(xiàn)高濃度的乳酸(通常與“Warburg 效應(yīng)”有關(guān))可能有助于在巨噬細(xì)胞中誘導(dǎo) PF4。常規(guī)和巨噬細(xì)胞特異性 PF4 缺陷小鼠在 TME 中均表現(xiàn)出腫瘤生長和 TH1-Treg 細(xì)胞比率降低。最后,當(dāng)我們在荷瘤小鼠中使用新生成的 mAb 對 PF4 [抗 PF4 mAb (#6-1-5)] 測試 PF4 中和作用時(shí),TME 中的腫瘤生長和 TH1-Treg 細(xì)胞比率均降低,導(dǎo)致抗腫瘤免疫力增強(qiáng)。
結(jié)論:
作者發(fā)現(xiàn) Arg1+TAM分泌的 PF4 是 TME 中 TH1-Treg 細(xì)胞積累的關(guān)鍵決定因素,它抑制抗腫瘤免疫并促進(jìn)腫瘤生長。此外,PF4 中和抑制 TH1-Treg 細(xì)胞極化并抑制腫瘤生長。鑒于癌癥基因組圖譜的數(shù)據(jù)表明,PF4+TAM 數(shù)量的增加與人類預(yù)后較差相關(guān),PF4 代表了癌癥免疫治療的潛在新靶點(diǎn)。
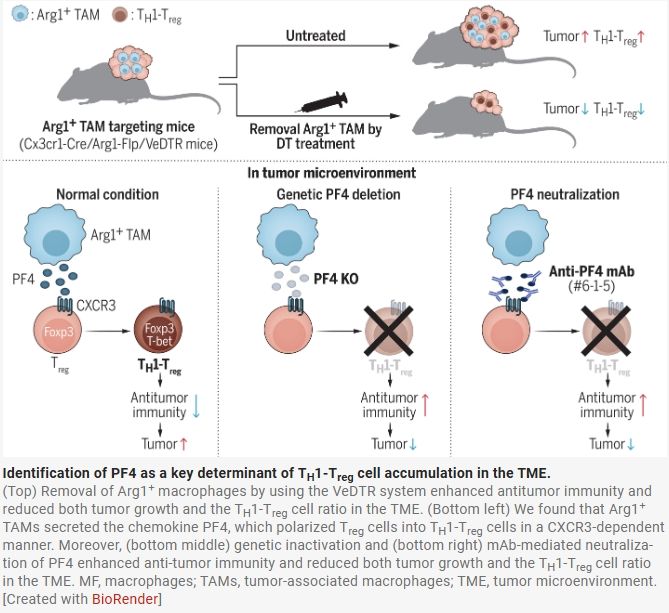
為探究TAMs在TME中TH1-Treg細(xì)胞高比例存在中的作用,作者開發(fā)了一種基因系統(tǒng)。已知TAMs表達(dá)精氨酸酶I(Arg1),其在腫瘤中高度且特異性表達(dá)。作者通過使用VeDTR小鼠系統(tǒng)并選擇Cx3cr1和Arg1基因,能夠特異性靶向并清除Arg1+ TAMs。在荷瘤的Cx3cr1-Cre/Arg1-Flp/VeDTR(LF)小鼠中,YFP僅在腫瘤浸潤的CD11b+ Ly6G–細(xì)胞中檢測到,且DTR在TAMs中強(qiáng)烈表達(dá)。注射DT后,YFP+ CD11b+細(xì)胞被耗竭,腫瘤生長顯著受抑,證明了TAM耗竭系統(tǒng)的有效性。
作者發(fā)現(xiàn),Arg1+ TAMs的耗竭對TME中TH1-Treg細(xì)胞的狀態(tài)有顯著影響。流式細(xì)胞術(shù)和質(zhì)譜流式細(xì)胞術(shù)分析顯示,MC38和B16F10腫瘤中Foxp3+ T-bet+ CD4+ T細(xì)胞(TH1-Treg細(xì)胞)的比例顯著降低。此外,T-bet+ LAG-3– CD8+ T細(xì)胞的比例增加,而其他細(xì)胞群的比例相對不變,表明Arg1+ TAM耗竭導(dǎo)致免疫抑制性的TH1-Treg細(xì)胞減少,免疫刺激性的CD11b+細(xì)胞和T-bet+ LAG-3– CD8+ T細(xì)胞增加,從而增強(qiáng)了抗腫瘤免疫。
機(jī)制上,TAMs分泌PF4,使Treg細(xì)胞極化為TH1-Treg細(xì)胞。作者對腫瘤中Arg1+ TAMs和Treg細(xì)胞的定位進(jìn)行檢測,發(fā)現(xiàn)它們距離很近,可能存在相互作用。共培養(yǎng)實(shí)驗(yàn)表明,Arg1+ TAMs可使非TH1-Treg細(xì)胞極化為TH1-Treg細(xì)胞。通過RNA測序分析,作者確定PF4為候選因子。重組PF4蛋白以CXCR3依賴的方式誘導(dǎo)TH1-Treg細(xì)胞極化。PF4還增強(qiáng)了TH1-Treg細(xì)胞的抑制功能,并且發(fā)現(xiàn)其在Arg1+ TAMs中特異性高表達(dá)。此外,IFN-γ參與了Treg細(xì)胞上CXCR3的初始表達(dá),PF4進(jìn)一步增強(qiáng)了TH1-Treg細(xì)胞極化。TME中PF4的主要來源是Arg1+ TAMs,因?yàn)樗鼈儽犬a(chǎn)生CXCL9的cDC1s更為豐富。
作者構(gòu)建了Pf4?/?小鼠,發(fā)現(xiàn)其Arg1+ TAMs和非巨噬細(xì)胞類型中的PF4產(chǎn)生被消除。與野生型小鼠相比,Pf4?/?小鼠的腫瘤生長延遲,腫瘤中TH1-Treg細(xì)胞比例顯著降低,而脾臟中的比例相當(dāng)。為評估巨噬細(xì)胞來源的PF4的貢獻(xiàn),作者構(gòu)建了Cx3cr1-Cre/Pf4fl/fl小鼠。在這些小鼠中,Arg1+ TAMs中的PF4產(chǎn)生存在缺陷,但血小板中的PF4產(chǎn)生正常。腫瘤生長減少,腫瘤中TH1-Treg細(xì)胞比例降低,表明巨噬細(xì)胞來源的PF4在促進(jìn)TH1-Treg細(xì)胞積累和腫瘤生長中起主要作用。
最后,生成了一種新的PF4單克隆抗體(#6-1-5),可有效中和PF4誘導(dǎo)的TH1-Treg細(xì)胞極化。在荷瘤小鼠中施用抗PF4 mAb(#6-1-5)可減少腫瘤生長并降低腫瘤中TH1-Treg細(xì)胞比例,而脾臟中的比例不變。這伴隨著IFN-γ+/TNF-α+ CD4+ T細(xì)胞和CD8+ T細(xì)胞比例的增加,表明抗腫瘤免疫增強(qiáng)。抗PF4 mAb治療不影響Treg細(xì)胞向TME的遷移,也對CD8+ T細(xì)胞無直接影響。抗腫瘤效應(yīng)依賴于免疫,因?yàn)樵赗AG2缺陷小鼠中該效應(yīng)消失。PF4中和也被證明比完全耗竭Treg細(xì)胞更安全。與抗CTLA4 mAb的比較表明,抗PF4 mAb即使對TH1-Treg細(xì)胞的適度減少也能有效增強(qiáng)抗腫瘤免疫。對TCGA數(shù)據(jù)的分析顯示,較高的PF4表達(dá)水平與癌癥患者較差的預(yù)后相關(guān)。
總之,研究確定了Arg1+ TAM分泌的PF4是TME中TH1-Treg細(xì)胞積累的關(guān)鍵決定因素,其抑制抗腫瘤免疫并促進(jìn)腫瘤生長。基因敲除或抗體介導(dǎo)的PF4中和抑制了TH1-Treg細(xì)胞極化并減少了腫瘤生長。這些發(fā)現(xiàn)為TME中抗腫瘤免疫調(diào)節(jié)的分子機(jī)制提供了新見解,并提示PF4作為癌癥免疫治療的潛在靶點(diǎn)。未來的研究需要進(jìn)一步闡明PF4的作用及其與其他因素在不同腫瘤模型和臨床環(huán)境中的相互作用。
荷蘭Liposoma的巨噬細(xì)胞清除劑Clodronate Liposomes,氯膦酸鹽脂質(zhì)體,廣泛用于體內(nèi)單核巨噬細(xì)胞清除。頻頻登刊Cell,Nature和Science。如需訂購,可以隨時(shí)聯(lián)系,技術(shù)支持可以聯(lián)系大中華獨(dú)家代理商靶點(diǎn)科技(Target Technology),專業(yè)技術(shù)團(tuán)隊(duì)給您巨噬細(xì)胞清除提供整套解決方案。
原始文獻(xiàn):
Ayumi Kuratani et al. ,Platelet factor 4–induced TH1-Treg polarization suppresses antitumor immunity. Science 386,eadn8608(2024). DOI:10.1126/science.adn8608

獨(dú)家代理
中國大陸地區(qū)
生產(chǎn)廠家
歐洲荷蘭王國
獨(dú)家代理
香港臺灣澳門
Copyright ? 2004-2023 靶點(diǎn)科技(北京)有限公司. 版權(quán)所有. 京ICP備18027329號-1