2024年11月27日,奧地利維也納生物中心分子病理學研究所(Research Institute of Molecular Pathology簡稱IMP)及其團隊,在國際知名期刊Nature(IF:50.5)發表了題為“ Cancer cells impair monocyte-mediated T cell stimulation to evade immunity”的研究性論文。該研究發現,發現腫瘤中的髓系細胞組分發生了重編程,與未經治療腫瘤(NTT)相比,已經耐藥腫瘤(RTT)中的單核細胞減少,而免疫抑制性腫瘤相關巨噬細胞(TAM)增加。炎性單核細胞通過“交叉穿戴”(cross-dressing)機制,獲取腫瘤細胞的抗原并激活T細胞,從而推動抗腫瘤免疫反應的發生。而且與DCs主要進行交叉呈遞抗原不同,單核細胞激活CD8+T細胞的機制主要是“MHC變裝”(cross-dressing),即從癌細胞處直接捕獲MHC I類分子-肽復合體,再呈遞給CD8+T細胞激活免疫應答。當然,癌細胞一向是不會老實束手被擒的,它們也會通過激活MAPK信號通路,下調I型干擾素(IFN-I)應答和分泌更多前列腺素E2(PGE2)這兩種手段,來反制單核細胞功能、限制CD8+T細胞的激活。如果能反過來破解癌細胞的這兩招,就能有效激活CD8+T細胞,助力免疫治療。

腫瘤微環境(tumor microenvironment, TME)由腫瘤細胞和各種免疫細胞共同構成,是一個動態且復雜的微生態系統。在這里,CD8+ T細胞通過初始激活和局部再激活,獲得對抗腫瘤的持續能力。然而,這種再激活過程需要特定的免疫細胞參與和支持,才能有效遏制腫瘤的生長。在抗腫瘤免疫應答的過程中,CD8+T細胞并不是“一次激活、長期有效”一勞永逸的,雖然在腫瘤引流淋巴結內被DCs等抗原呈遞細胞激活后,CD8+T細胞浸潤到腫瘤部位時大多已做好了戰斗準備,但要想維持高昂的戰斗力,CD8+T細胞往往還需要腫瘤微環境中其它免疫細胞的“再刺激”(restimulation),而參與該過程的免疫細胞類型此前并不明確。這也就是奧地利研究者們本次研究的切入點,研究者們選擇以BRAF V600E突變型黑色素瘤作為研究對象,這類腫瘤在對現有靶向治療(BRAFi+MEKi)逐步產生獲得性耐藥的同時,腫瘤微環境也會轉變為免疫逃逸性,導致對免疫治療的“交叉耐藥”。初步實驗的結論與既往探索一致,即在體外實驗中面對已激活的腫瘤特異性CD8+T細胞面前,未經治療(NTT)或已經耐藥(RTT)的黑色素瘤細胞都無法抵御殺傷,但實驗換到模型小鼠體內進行時,CD8+T細胞就無法清除RTT腫瘤,而腫瘤微環境中發生的相應改變,則是單核細胞占比顯著減少,免疫抑制性腫瘤相關巨噬細胞(TAMs)大增,與NTT腫瘤微環境中單核細胞占免疫細胞比例最多就完全不同。
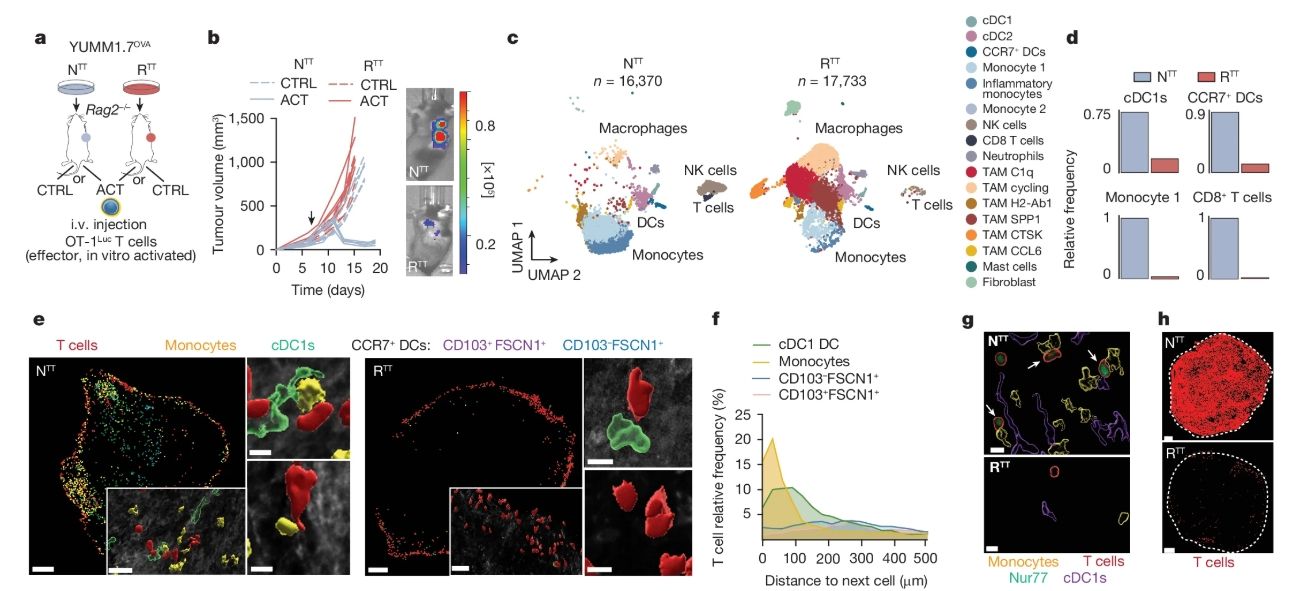
本研究,炎性單核細胞也在T細胞的再激活中發揮著至關重要的作用。針對YUMM1.7小鼠黑色素瘤模型的實驗表明,在未經靶向NTT治療的腫瘤中,炎性單核細胞在腫瘤微環境中的比例高達40%,而在耐藥性腫瘤RTT中則顯著下降到10%左右。這種差異性表明,炎性單核細胞在維持腫瘤局部免疫反應中具有不可或缺的作用。炎性單核細胞通過“交叉穿戴”(cross-dressing)機制,從腫瘤細胞上獲取并展示肽-MHC-I復合物,以此來激活CD8+ T細胞。在NTT(未經治療)腫瘤中,實驗發現腫瘤特異性CD8+ T細胞與炎性單核細胞之間形成了多細胞聚集體。這種接觸導致80%以上的T細胞上調Nur77,這是T細胞受體(TCR)活化的標志。然而,在耐藥性腫瘤中,這一比例大幅下降至20%。這些數據清晰地表明,炎性單核細胞在維持T細胞活化狀態中扮演了重要角色。深入研究發現,腫瘤細胞內MAPK信號通路的過度激活是這一機制受抑的主要原因。具體來說,MAPK信號的異常激活會抑制Ⅰ型干擾素(type I interferon, IFN-I)的產生(降低70%),并增加前列腺素E2(prostaglandin E2, PGE2)的分泌(增加約2.5倍)。PGE2不僅直接抑制了炎性單核細胞的功能,還阻斷了它們與T細胞之間的有效相互作用,從而顯著削弱了T細胞的再激活能力。
為了更好地理解炎性單核細胞在腫瘤免疫中的作用,研究者們還分析了這些細胞在不同腫瘤發展階段的動態行為。在腫瘤的早期階段,炎性單核細胞通過釋放趨化因子來招募其他免疫細胞,而在腫瘤的晚期,它們的功能逐漸轉向直接遞呈抗原并激活局部的T細胞。這種功能的動態變化使炎性單核細胞能夠根據腫瘤微環境的需求做出相應調整,極大地影響了整體的免疫應答效果。在腫瘤微環境中,免疫細胞間的協作決定了抗腫瘤免疫反應的強度和持續性。CD8+ T細胞需要與炎性單核細胞的直接相互作用,才能有效地重新獲得殺傷腫瘤細胞的能力。研究發現,這種直接接觸不僅是細胞之間的物理接觸,更是一系列復雜信號傳導的結果,涉及抗原呈遞、共刺激信號以及局部免疫因子的調控。因此,炎性單核細胞的存在與功能狀態對維持腫瘤內的免疫平衡具有關鍵作用。
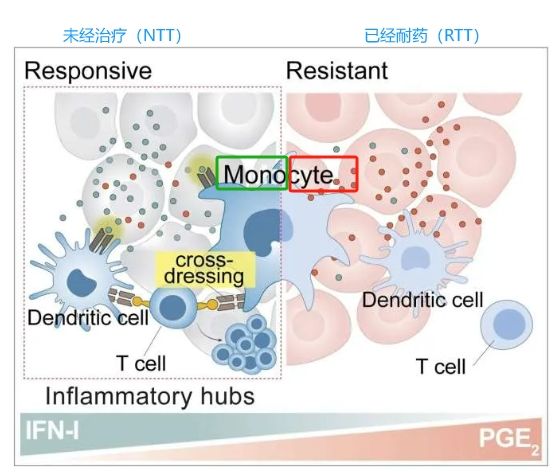
癌細胞通過抑制單核細胞介導的T細胞再激活來逃避免疫監視,這一發現揭示了腫瘤微環境中復雜且動態的免疫逃逸機制。通過調節IFN-I和PGE2這兩個重要的信號因子,可以開發出更加有效的組合免疫療法,使癌癥治療不僅局限于傳統的放化療和手術干預,而是通過增強機體的免疫反應實現更持久的抗腫瘤效果。這項研究為理解癌癥的免疫逃逸機制提供了新的見解,也為未來癌癥免疫治療的創新指明了方向。未來的研究可以更加集中于如何優化炎性單核細胞的功能,如何通過調節腫瘤細胞釋放的信號來進一步提高T細胞的激活效率。這些發現為個性化治療提供了新的視角,使得單核細胞有望成為促進免疫治療的靶點,并有可能使受與黑色素瘤分子途徑相似的癌癥影響的廣泛患者受益。這些癌癥包括肺癌、胰腺癌和結直腸癌。
該研究還顯示了癌細胞是如何通過使T細胞難以保持激活狀態并有效發揮作用來逃避免疫的。癌細胞會增加前列腺素E2(prostaglandin E2)分子的產生,這種分子會阻止單核細胞和樹突狀細胞的活動。同時,癌細胞會減少刺激免疫活動的干擾素(interferons)分子的產生,從而進一步削弱免疫系統對抗腫瘤的能力。Guillem Estivill解釋說:“我們已經看到,通過激活單核細胞,恢復這些分子的水平可以使T細胞恢復其殺死癌癥的作用。”基于這一發現,一種有希望的策略是使用COX抑制劑(COX inhibitors),如阿司匹林藥物(aspirin—drugs),阻斷環氧化酶(cyclooxygenase簡稱COX)的酶,這種酶負責產生引起炎癥的分子,如前列腺素E2(prostaglandin E2)。此外,刺激干擾素的產生可以增強免疫系統對抗癌癥的能力。這些方法可以與現有的免疫療法相結合,為目前對治療有抗藥性的癌癥提供新的工具。
荷蘭Liposoma的巨噬細胞清除劑氯膦酸二鈉脂質體Clodronate Liposomes,氯膦酸鹽脂質體,廣泛用于體內單核巨噬細胞清除。頻頻登刊Cell,Nature和Science。如需訂購,可以隨時聯系。技術支持可以聯系大中華獨家代理商靶點科技(Target Technology),專業技術團隊給您單核巨噬細胞清除提供整套解決方案。
原始文獻
Elewaut A, Estivill G, Bayerl F, et al. Cancer cells impair monocyte-mediated T cell stimulation to evade immunity. Nature, 2024. https://www.nature.com/articles/s41586-024-08257-4

獨家代理
中國大陸地區
生產廠家
歐洲荷蘭王國
獨家代理
香港臺灣澳門
Copyright ? 2004-2023 靶點科技(北京)有限公司. 版權所有. 京ICP備18027329號-1