2024年8月9日,阿爾伯特·愛因斯坦醫學院Ulrich Steidl、Britta Will、Xin Gao教授團隊,在國際知名期刊Science(IF=56.9)在線發表題為:Regulation of the hematopoietic stem cell pool by C-Kit–associated trogocytosis的論文。 研究了控制造血干細胞(HSC)行為的復雜機制。該研究揭示了HSC調控的一個新方面,突出了trogocytosis(胞啃)的作用。trogocytis是一種細胞在HSC及其與巨噬細胞相互作用中交換膜物質的過程。
造血干細胞(HSC)通常從骨髓(BM)動員到血液循環中用于臨床移植。然而,單個干細胞離開骨髓的確切機制尚不清楚。研究人員確定了可動員造血干細胞池的細胞外源性和分子決定因素。研究人員發現,一部分HSC在其細胞表面顯示巨噬細胞相關標記(F4/80)。盡管功能齊全,但與缺乏巨噬細胞標志物的干細胞相比,這些造血干細胞選擇性地保留生態位,而巨噬細胞標志物在被迫動員后會離開骨髓。HSC上的巨噬細胞標志物可以通過胞啃作用(trogocytosis)直接從小鼠和人類環境中的骨髓駐留巨噬細胞轉移而獲得,并由受體酪氨酸蛋白激酶C-Kit(CD117)調節。總之,這一研究提供了概念證明,即成體干細胞利用吞噬作用快速建立和激活調節功能的分子機制。

介紹:
造血干細胞 (HSC) 產生所有類型的血細胞,并確保造血系統的終生維持和補充。這些成體干細胞存在于骨髓 (BM) 中的特殊微環境中,但表現出一種獨特的行為,即其一小部分細胞群不斷從 BM 中排出,進入血液循環——這一過程被稱為“干細胞動員”。在臨床上,通過暴露于粒細胞集落刺激因子 (G-CSF) 或 C-X-C 趨化因子受體 4 型 (CXCR4) 拮抗劑,通過藥理學調節造血細胞因子信號傳導來強制 HSC 動員,從而利用這一特性。從外周血中獲取動員的造血干細胞用于隨后的造血干細胞移植,例如,用于治療癌癥、自身免疫性疾病和其他疾病患者。
原理:
控制個體造血干細胞動員到血液中的機制尚不完全清楚。此外,目前的治療方案在相當大比例的患者中無法刺激足夠數量的 HSC 的 BM 流出。因此,我們分析了從小鼠分離的 HSC 表面表達的蛋白質,并研究了大多數 HSC 能夠保留在 BM 中而其他 HSC 可以被動員的機制。
結果:
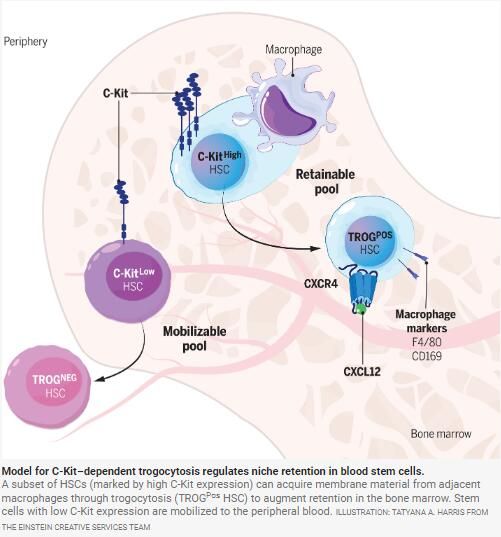
研究者發現,大部分 HSC 在其細胞表面顯示巨噬細胞相關標記物,包括 F4/80 和 CD169。我們評估了表達或不表達巨噬細胞標志物的 HSC 的長期再生多譜系再繁殖能力以及在強制動員或衰老時從 BM 動員的能力。巨噬細胞標志物呈遞的造血干細胞功能完全,并且大部分保留在 BM 中,而沒有可檢測到巨噬細胞標志物呈遞的干細胞在強制動員時很容易退出 BM。利用 HSC 和巨噬細胞的體外共培養,我們發現 HSC 可以使用滋養細胞增多 (TROGPos HSCs)——一種表面分子的快速而活躍的轉移機制,其中質膜片段從一個細胞運輸到另一個細胞。在干細胞因子存在下,滋養細胞作用受損。因此,我們利用遺傳和藥理學小鼠模型,以及基于原代人類細胞的測定法,來追蹤巨噬細胞膜材料如何轉移到造血干細胞上。這些努力將受體酪氨酸激酶 C-Kit 確定為干細胞細胞細胞增多癥的標志物,并表明在其細胞表面呈遞高 C-Kit 的 HSC 可以參與這種機制,從鄰近的巨噬細胞獲取 CXCR4,以增加干細胞在生態位中的保留。
結論:
研究者發現了一個可定義的可動員干細胞庫,并證明巨噬細胞的膜片段轉移可以被 HSC 功能化以保留 BM。我們的研究提供了概念證明,即成體干細胞可以利用滋養細胞作用快速建立和激活功能調節分子機制。這些發現對在臨床上開發更有效的 HSC 動員策略具有重要意義,可能通過利用 C-Kit 的藥理學損傷。它們還將激發人們的努力,以描述造血干細胞在其他情況下使用滋養細胞增多作用來急性獲得功能的程度,以及造血系統可能在多大程度上使用滋養細胞作用介導的細胞殺傷來消除有缺陷的干細胞。
該研究首先檢查了HSC的表型特征,發現一個重要的亞群表達F4/80,一種典型的巨噬細胞標志物。這一發現表明HSC和巨噬細胞之間存在潛在的聯系,而巨噬細胞通常與免疫功能有關。研究人員繼續證明,與F4/80陰性HSC相比,F4/80+HSC的再生能力更低。移植后受體小鼠的嵌合體降低證明了這一點,表明F4/80+HSC可能對造血系統的再生沒有那么有效的貢獻。
進一步研究F4/80+和F4/80-HSC的動員潛力顯示出顯著差異。F4/80+造血干細胞對動員具有抵抗力,即使在通常促進造血干細胞釋放到血液中的條件下,也會留在骨髓中。這種頑固行為在G-CSF和AMD3100(常用于臨床環境的CXCR4拮抗劑)等各種動員刺激中是一致的。HSC上F4/80表達的年齡相關性變化也與動員模式相關,老年小鼠的F4/80+HSC減少,動員的HSC增加。
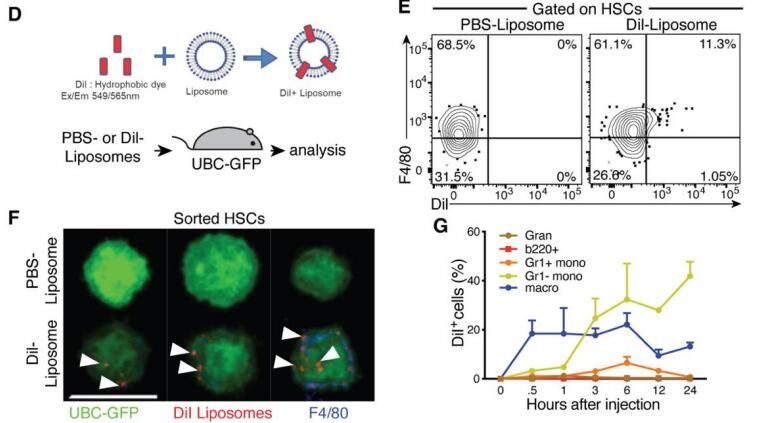
然后,該研究探討了HSC獲取巨噬細胞相關標志物背后的機制。利用能追蹤CD169表達的遺傳模型,研究人員發現HSC不僅可以通過細胞轉移獲得F4/80,還可以獲得CD169。這種轉移不是由于HSC本身內基因表達的增加造成的,而是通過從鄰近巨噬細胞攝取膜物質形成的。驗證實驗表明,熒光標記TdTomato可以在小鼠和人類系統中從巨噬細胞轉移到HSC。
研究人員深入研究了這種細胞轉移的功能影響,重點研究了CXCR4的作用——CXCR4是一種對HSC在骨髓中的保留至關重要的趨化因子受體。他們觀察到F4/80+HSC在其細胞表面顯示出更高水平的CXCR4,與它們對CXCR4配體CXCL12的反應性增強有關。這表明,從巨噬細胞中獲取CXCR4可能是HSC在骨髓生態位中保留的關鍵因素。
該研究確定了胞啃作用是介導膜物質從巨噬細胞轉移到HSC的機制。時間過程分析和在較低溫度下抑制轉移的現象證明,這個過程很快,需要直接的細胞接觸。肌動蛋白聚合的參與,如細胞松弛素D對轉移的抑制所示,進一步支持了胞啃在這種細胞相互作用中的作用。
該研究還強調了受體酪氨酸激酶C-Kit在HSC胞啃中的調節作用。干細胞因子(SCF)是C-Kit的配體,它的存在會損害胞啃作用,表明C-Kit信號傳導可能會負調控這一過程。伊馬替尼(imatinib,一種泛酪氨酸激酶抑制劑)的使用進一步證實了這一點,它可以減少造血干細胞中的胞啃作用。該研究還觀察到c-Kit表達與HSC上F4/80表達呈正相關,強化了c-Kit在HSC行為中的調節作用。
將這些發現擴展到人類造血干細胞,作者也觀察到巨噬細胞標志物的存在。特別是與動員的外周血造血干細胞相比,骨髓來源的造血干細胞的巨噬細胞標志物表達更高。C-Kit表達與人類HSC中巨噬細胞標志物存在之間的相關性與小鼠模型中的觀察結果相似,強調了這些發現的轉化相關性。
總之,此研究全面了解了HSC和巨噬細胞之間的復雜相互作用,揭示了胞啃作用是調節HSC行為的關鍵機制。這項研究不僅加深了我們對HSC生物學的理解,還為制定治療策略開辟了新的途徑,可能改善HSC在臨床應用如造血干細胞移植中的動員。
相關研究:
2022年9月22日,Science發表題為Quality assurance of hematopoietic stem cells by macrophages determines stem cell clonality研究論文,巨噬細胞是造血干細胞HSC質量的控制者。詳情參考鏈接:巨噬細胞對造血干細胞HSC的質量控制。 在2022年9月22日發表的論文中,作者使用了我們荷蘭Liposoma的巨噬細胞清除劑Clodronate Liposomes(貨號CP-005-005)氯膦酸二鈉脂質體巨噬細胞清除套裝。在2024年8月9日的這篇研究中,作者使用了巨噬細胞示蹤熒光脂質體Dil Liposomes。
原始文獻:
Xin Gao et al. Regulation of the hematopoietic stem cell pool by C-Kit–associated trogocytosis. Science 385,eadp2065(2024).

獨家代理
中國大陸地區
生產廠家
歐洲荷蘭王國
獨家代理
香港臺灣澳門
Copyright ? 2004-2023 靶點科技(北京)有限公司. 版權所有. 京ICP備18027329號-1