2024年4月24日,日本大阪大學(xué)的Masaru Ishii教授團隊,在國際知名期刊Nature(IF:64.8)發(fā)表了題為“ Periportal macrophages protect against commensal-driven liver inflammation”的研究性論文。作者發(fā)現(xiàn)肝臟門靜脈區(qū)域存在一種特殊的肝臟駐留巨噬細(xì)胞,具有免疫抑制特性,依賴于一種與百歲老人長壽相關(guān)的腸道微生物及其代謝產(chǎn)物來抑制肝臟的炎癥反應(yīng)。特別是在腸道屏障受損時,這些巨噬細(xì)胞的存在對防止肝炎尤為關(guān)鍵。

肝臟和腸道通過門靜脈直接相連,門靜脈是將腸道吸收的營養(yǎng)物直接輸送到肝臟的血管。腸道中含有大量腸道細(xì)菌,有時這些細(xì)菌及其相關(guān)物質(zhì)會通過門靜脈進入肝臟。當(dāng)腸道屏障受到破壞(比如在潰瘍性結(jié)腸炎或腸道滲漏綜合癥等疾病中發(fā)生的情形)時,這種情形就會特別嚴(yán)重,使得許多腸道細(xì)菌和相關(guān)物質(zhì)進入肝臟。在正常情況下,肝臟的免疫系統(tǒng)能夠抵御入侵的腸道細(xì)菌和相關(guān)物質(zhì),防止炎癥,但這背后的確切機制尚不清楚。
肝臟的不同區(qū)域,尤其是門靜脈區(qū)(PV)和中心靜脈區(qū)(CV),展示出明顯的細(xì)胞分布和功能異質(zhì)性。了解不同區(qū)域的免疫細(xì)胞有何差異之處,對肝臟的代謝和免疫調(diào)節(jié)功能至關(guān)重要。在這項研究中,Masaru Ishii及其同事們首先對小鼠肝臟樣本進行單細(xì)胞轉(zhuǎn)錄組學(xué)分析,精細(xì)區(qū)分肝門靜脈區(qū)與中心靜脈區(qū)的巨噬細(xì)胞,以在細(xì)胞層面上觀察巨噬細(xì)胞基因表達的異質(zhì)性。他們發(fā)現(xiàn)一種主要集中在肝門脈區(qū)的特殊巨噬細(xì)胞亞群,顯示出顯著的抗炎特性,以高表達清道夫受體Marco蛋白為特征(Marco+),同時高表達IL-10等抗炎細(xì)胞因子,能夠抑制介導(dǎo)炎癥反應(yīng)的中性粒細(xì)胞過度聚集。有了這些肝臟駐留巨噬細(xì)胞的把關(guān),肝門靜脈區(qū)的中性粒細(xì)胞浸潤水平明顯低于中心靜脈區(qū),無論是損傷還是穩(wěn)定狀態(tài)下。
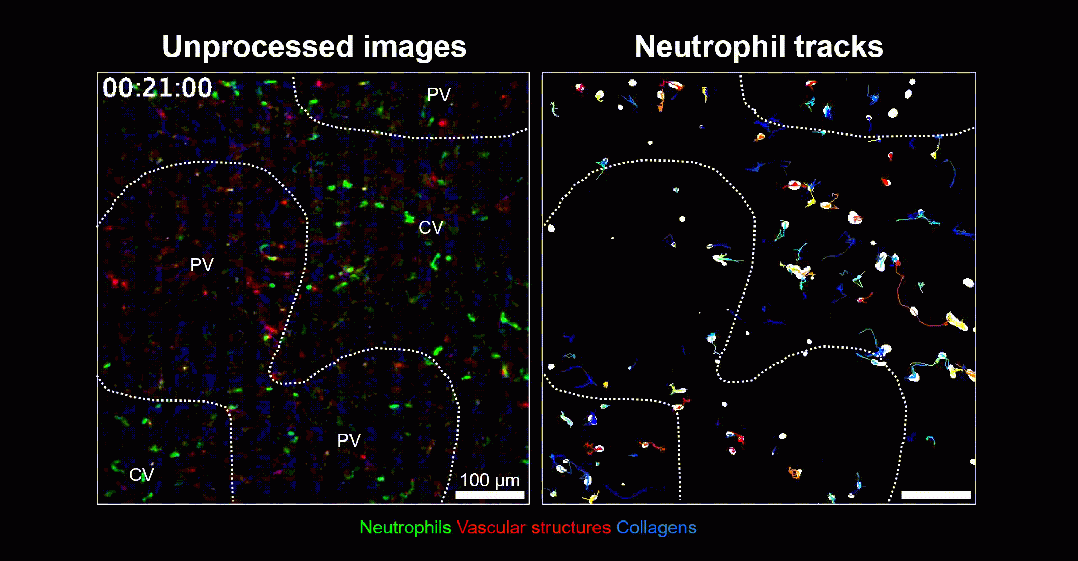
PV區(qū)的中心粒細(xì)胞少
通過對比不同腸菌定植情況的小鼠,研究者們揭示,這些巨噬細(xì)胞的免疫抑制功能依賴于特定的腸道細(xì)菌家族——Odoribacteraceae(Odori)。Odori通過其代謝產(chǎn)物isoallo-LCA激活門靜脈中巨噬細(xì)胞的特定信號通路,促使它們表達Marco蛋白增強其抗炎能力,Odori的腸道定植豐度與Marco+肝臟駐留巨噬細(xì)胞水平呈正相關(guān)。Marco蛋白是清道夫受體家族的成員,僅在特定類型的巨噬細(xì)胞上表達。通過識別和響應(yīng)損傷相關(guān)分子模式(DAMPs)或病原相關(guān)分子模式(PAMP),Marco幫助調(diào)節(jié)身體的免疫反應(yīng),控制炎癥和促進組織恢復(fù)。在接收到Odori來信的肝臟駐留巨噬細(xì)胞細(xì)胞中,Marco的信號傳導(dǎo)進一步激發(fā)IL-10等抗炎細(xì)胞因子的產(chǎn)生,抑制中性粒細(xì)胞在門靜脈區(qū)的黏附以減少其聚集。給小鼠直接口服isoallo-LCA,便可以誘導(dǎo)肝臟駐留巨噬細(xì)胞表達Marco,增加IL-10表達水平。
至于Marco+巨噬細(xì)胞為何主要存在于肝臟門靜脈而不是中心靜脈,研究者們認(rèn)為追根溯源還是為了提防腸道。來自腸道的血液能夠通過門靜脈直接進入肝臟,這種機制導(dǎo)致肝臟更易于受到腸道微生物失衡的影響,腸道發(fā)生感染時連帶引發(fā)多種炎癥性肝病。于是,研究者們進一步在腸道屏障受損的小鼠疾病模型中觀察到,Marco+肝臟駐留巨噬細(xì)胞在調(diào)節(jié)肝臟免疫反應(yīng)中扮演關(guān)鍵角色,特別是在肝門靜脈區(qū)的免疫抑制和抗炎癥過程中尤為重要。敲除Marco會導(dǎo)致慢性結(jié)腸炎小鼠的肝臟中炎癥性淋巴細(xì)胞(TH17細(xì)胞)和中性粒細(xì)胞顯著增加,同時血清中肝損傷標(biāo)志物、肝纖維化標(biāo)志物提高。
如果通過調(diào)整飲食誘導(dǎo)小鼠肝臟脂質(zhì)異常積累,誘發(fā)非酒精性脂肪性肝病(NAFLD),可以觀察到小鼠的Marco+肝臟駐留留巨噬細(xì)胞在喂食兩周后就減少64.5%。而對于Marco表達缺失的小鼠,這種飲食會誘發(fā)更嚴(yán)重的肝臟炎癥,門靜脈周圍脂肪變性加劇。此外,與健康對照組相比,非酒精性脂肪性肝病或原發(fā)性硬化性膽管炎(PSC)患者的肝樣本中,巨噬細(xì)胞總數(shù)相當(dāng),但Marco+巨噬細(xì)胞數(shù)量減少。這些發(fā)現(xiàn)提示Marco+肝臟駐留巨噬細(xì)胞與慢性炎癥性肝病變相關(guān)。
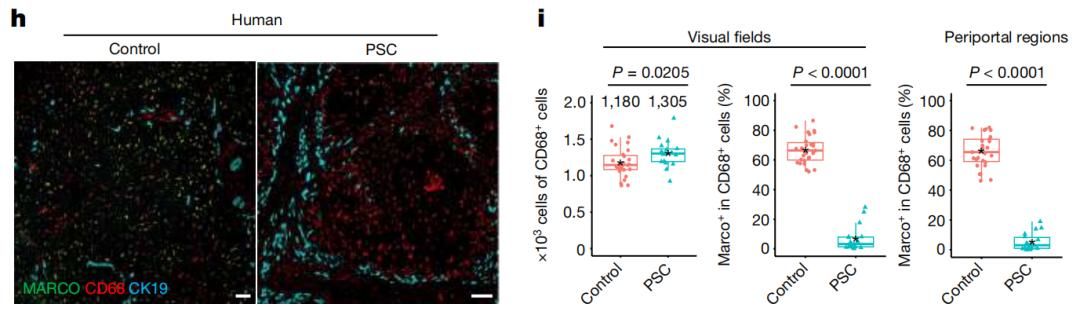
PSC患者肝臟中表達Marco的巨噬細(xì)胞占比減少
總之,從臨床意義上看,這項研究找到了肝臟為腸道設(shè)下的特殊防線,為非酒精性脂肪性肝病等常見且難治的肝病的治療和預(yù)防提供了新的靶點,未來或許可以通過調(diào)節(jié)腸道微生物群或直接利用Marco+肝臟駐留巨噬細(xì)胞的抗炎能力,為患者帶來希望。
原始文獻
Miyamoto, Y., Kikuta, J., Matsui, T. et al. Periportal macrophages protect against commensal-driven liver inflammation.Nature 629, 901–909 (2024). https://www.nature.com/articles/s41586-024-07372-6

獨家代理
中國大陸地區(qū)
生產(chǎn)廠家
歐洲荷蘭王國
獨家代理
香港臺灣澳門
Copyright ? 2004-2023 靶點科技(北京)有限公司. 版權(quán)所有. 京ICP備18027329號-1