2025年1月17日,馬克斯·普朗克研究所Martin Beck和Gerhard Hummer以及海德堡大學Hans-Georg Krausslich團隊的研究人員,在國際知名期刊Cell(IF:45.5)發表了題為“Passage of the HIV capsid cracks the nuclear pore”的研究性論文。該突破性的研究,揭示了HIV病毒衣殼在穿越巨噬細胞核孔復合體(nuclear pore complex,NPC)時,不僅保持了結構的完整性,還會導致核孔復合體的環狀結構發生破裂。這一發現挑戰了傳統觀點,即病毒衣殼必須在核孔外解體才能進入細胞核。
在HIV病毒感染過程中,要感染靶細胞,HIV 病毒必須并到達細胞中心的細胞核,在那里產生足夠的遺傳密碼拷貝來感染其他細胞。為了安全地完成這一任務,這種病毒會構建一層保護性蛋白外衣——衣殼(capsid),以抵御宿主為消滅它而設置的病毒自身免疫防御系統。在此之前,完整的衣殼究竟如何穿過嵌在核膜上的核孔進入細胞核一直是個謎。
HIV-1感染的關鍵步驟之一是將其遺傳物質運輸到宿主細胞核內,并成功整合到宿主的基因組中。然而,宿主細胞核由雙層核膜包裹,核孔直徑僅約45至65納米,既能選擇性地運輸必要分子,又有效阻止了大多數外來成分的進入。核孔復合體(nuclear pore complex,NPC)選擇性地控制物質的進出來完成這一任務,這為HIV-1的核內入侵構成了一個重大的障礙。NPC是生物體內最大的蛋白質復合物之一,由約30種核孔蛋白 (Nups) 組成,這些蛋白共同構成了一個動態且高度選擇性的屏障。大多數病毒會在細胞質中解包衣殼,暴露出遺傳物質,并通過與核定位信號 (NLS) 相互作用的小分子復合物穿越NPC。然而,HIV-1的行為卻不同:其錐形衣殼(capsid)在細胞質中保持完整,直到進入細胞核后才完成解包。更為困惑的是,HIV衣殼的尺寸遠大于NPC的選擇性過濾閾值,這意味著其穿越機制具有獨特性。如何穿越核孔?一直是研究的熱點和難點。
HIV-1病毒的錐形衣殼(capsid)是一個復雜而精巧的多功能分子裝置。它由200-250個病毒衣殼蛋白(CA)六聚體和12個五聚體拼接而成,呈現出獨特的錐形結構。這種形狀不僅能夠緊密包裹病毒RNA基因組,為其提供物理保護,還能為病毒在細胞內的運輸和核內轉移提供重要支持。研究顯示,衣殼的寬端約為60納米,與核孔的內徑接近,而窄端的設計使其更容易插入核孔復合體(NPC)的中心通道。這種錐形設計堪稱病毒突破宿主防御系統的“進攻利器”。錐形衣殼的功能遠不止是一個“防護殼”。首先,它是病毒反轉錄(reverse transcription)的主要場所。在衣殼內,病毒的RNA基因組被逆轉錄為雙鏈DNA,從而為后續的基因組整合做好準備。同時,衣殼的存在還可以屏蔽宿主細胞內的DNA感受器,避免病毒在細胞質中被識別和清除。其次,衣殼與宿主細胞的微管馬達蛋白相互作用,使病毒能夠精準地被輸送至核孔位置。更重要的是,衣殼還能作為一種“分子鑰匙”,通過與核孔蛋白(FG-Nups)的特異性結合打開宿主細胞的核內屏障。HIV-1衣殼蛋白的六聚體能夠與核孔復合體中的FG-Nups特異性結合。這種結合不僅讓衣殼能夠附著在核孔上,還為其穿越核孔提供了足夠的牽引力。數據顯示,約有17%的核孔與病毒衣殼直接結合,而衣殼信號的89%分布在核孔附近。
巨噬細胞是人類免疫缺陷病毒1型(HIV-1)的主要靶點之一。研究人員探索HIV-1亞病毒復合物在人原代單核細胞衍生的巨噬細胞 (MDM) 中的核進入。巨噬細胞是 HIV-1 的天然靶細胞,并且是有絲分裂后細胞。因此,病毒復制復合物必須通過完整的核包膜(nuclear envelope,NE )進入細胞核。為了分析這一過程,作者利用了之前描述的非感染性 HIV-1 變體 (NNHIV),該變體正常進入允許細胞并經歷逆轉錄和核進入,但在整合和基因表達方面存在缺陷。
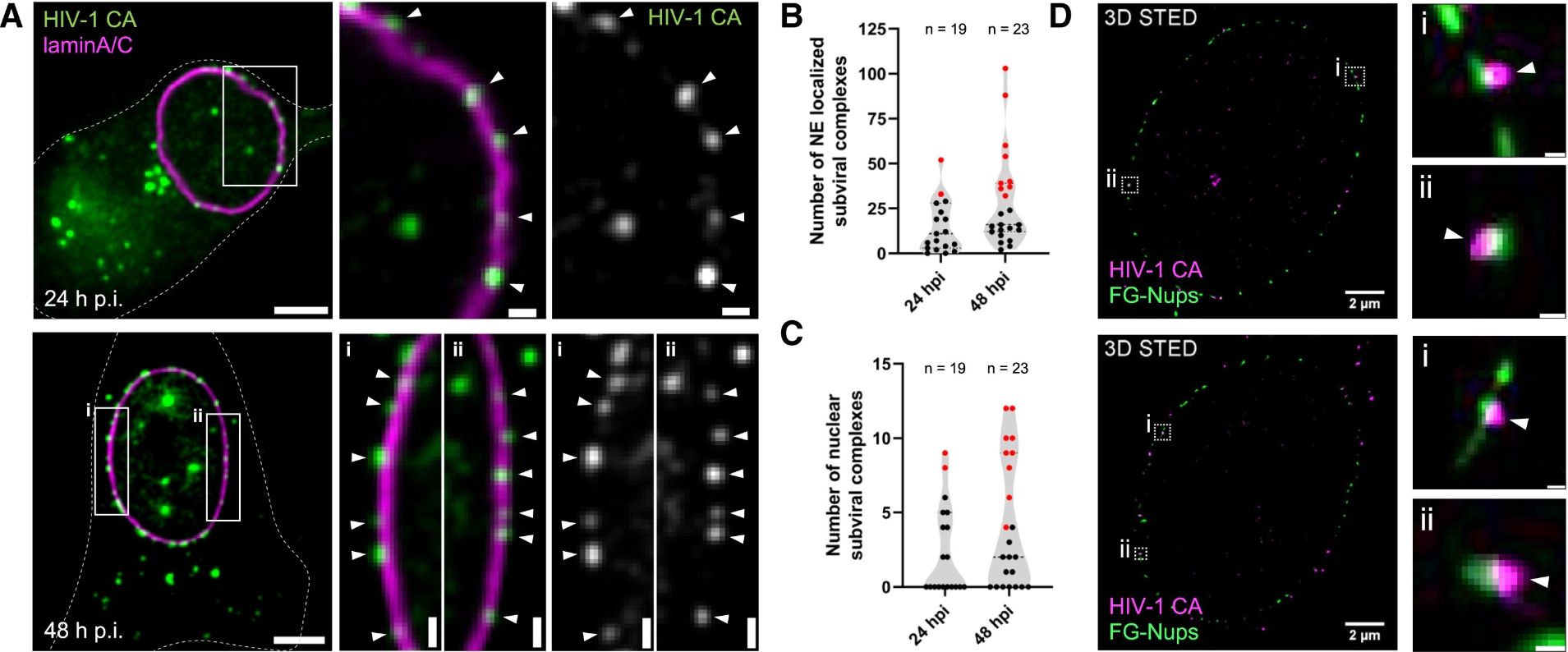
HIV-1衣殼在巨噬細胞(MDM)核孔復合體(NPC)處的積累
(A) 巨噬細胞中HIV-1 CA信號在核膜附近的分布
研究通過感染巨噬細胞樣本(MDMs)并在感染后24小時和48小時進行標記觀察,展示了HIV-1衣殼蛋白(CA,綠色信號)與核膜(由lamin A/C標記,洋紅色信號)的相對定位。在共聚焦顯微鏡的z切片圖中,可以清晰觀察到HIV-1 CA信號在細胞核膜(NE)處顯著積累。被lamin A/C信號定義的核膜區域顯示出明顯的CA信號聚集,尤其是在48小時后更為顯著。局部放大的圖像(標記為白色箭頭)揭示了CA信號精確分布在核膜的定義邊界處,這表明病毒衣殼與核孔復合體的關聯。
(B 和 C) 定量分析CA信號的分布
(B) CA信號與核膜(lamin A/C)的共定位:圖表顯示,與lamin A/C染色共定位的CA信號數量在感染后不同時期的變化。結果表明,感染時間延長后,越來越多的CA信號與核膜區域共定位,這進一步驗證了病毒衣殼在核孔復合體附近的積累趨勢。
(C) 核內CA信號數量:分析了核內檢測到的CA信號數量,結果顯示感染48小時后,進入細胞核內部的CA信號顯著增加。這表明病毒衣殼不僅在核孔處積累,還能夠穿越核膜進入細胞核。
(D) 使用3D STED成像對病毒與核孔的精確關聯進行深入解析
采用超分辨率的3D STED顯微成像技術,研究進一步解析了HIV-1 CA信號(洋紅色)與核孔蛋白(FG-Nups,綠色)的關聯。在整個細胞核的3D重建圖像中可以看到,CA信號直接位于由FG-Nups定義的核孔復合體區域附近或與之直接接觸。局部放大顯示,CA信號(白色箭頭)清晰地與核孔復合體標記的結構直接相關聯。這為病毒衣殼與核孔的物理交互提供了更直觀的證據。
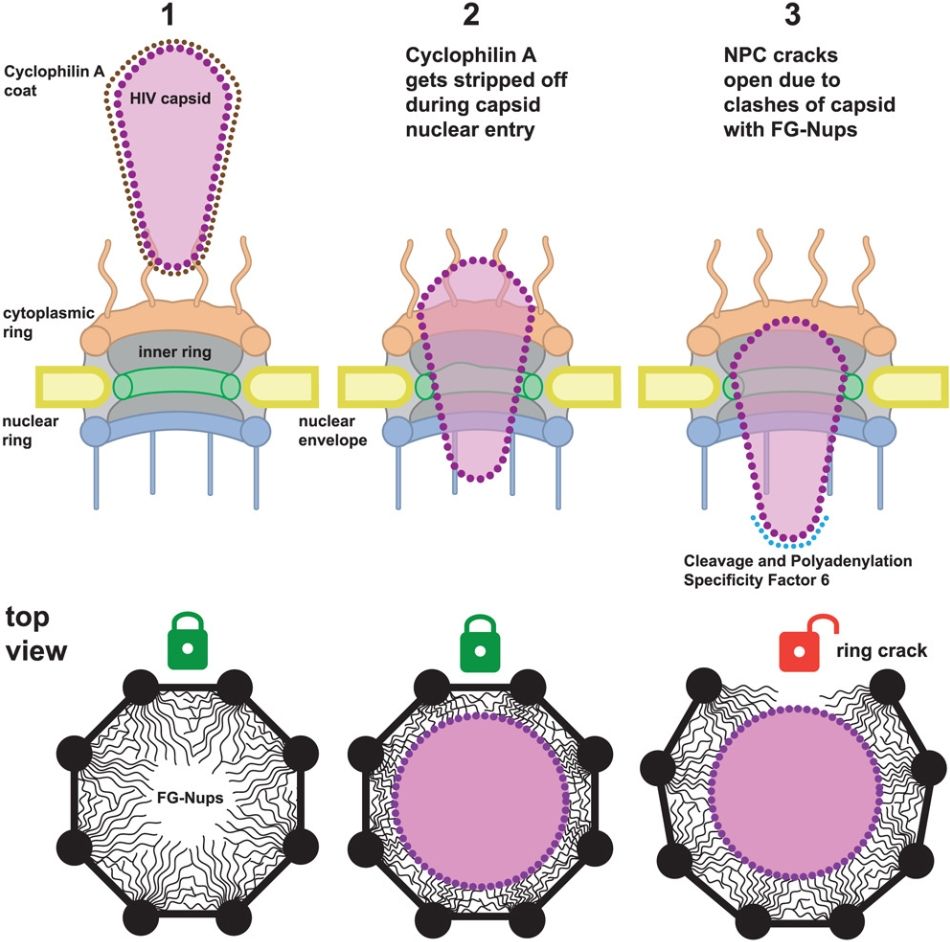
通過冷凍電鏡和分子模擬,研究人員觀察到病毒衣殼(capsid)在穿越核孔時會導致NPC的環狀結構出現“裂縫”。這種現象主要發生在NPC的內環區域(inner ring, IR),也就是核孔的最狹窄部分,也是病毒通過時需要克服的關鍵物理障礙。數據顯示,約有一半的核孔在與病毒衣殼結合后出現了擴張,甚至裂解現象。這種“裂縫”表現為核孔的環狀亞單位出現不對稱排列,原本具有8重對稱性的結構被破壞。通過分子模擬,研究還發現裂解的區域通常集中在衣殼接觸和推進的位置,這表明裂縫的產生與衣殼的機械作用力密切相關。令人驚訝的是,盡管核孔結構受損,宿主細胞的整體功能并未因此受到嚴重影響。HIV-1感染的巨噬細胞能夠長期存活,并未表現出明顯的核膜破裂或核孔完全喪失功能的現象。這表明,病毒可能在長期進化中找到了一種“恰到好處”的機制,既能成功突破核孔屏障,又能避免對宿主細胞造成過度損傷。對病毒而言,這種策略不僅提高了感染的成功率,還能為其在宿主內的長期潛伏創造條件。即雙方互相斗爭后最小妥協代價。
原始文獻
Kreysing, Jan Philipp et al.,Passage of the HIV capsid cracks the nuclear pore, Cell (2025).

獨家代理
中國大陸地區
生產廠家
歐洲荷蘭王國
獨家代理
香港臺灣澳門
Copyright ? 2004-2023 靶點科技(北京)有限公司. 版權所有. 京ICP備18027329號-1